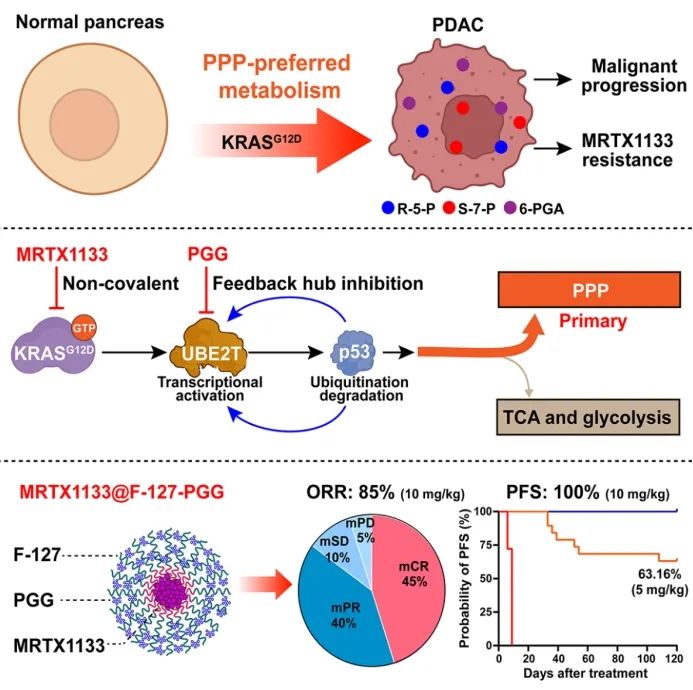
2025年2月18日,兰州大学第二医院焦作义教授团队在Cell Press出版社旗下期刊Cell Reports Medicine 发表了题为“KRASG12D-driven pentose phosphate pathway remodeling imparts a targetable vulnerability synergizing with MRTX1133 for durable remissions in PDAC”的研究论文。该研究发现KRASG12D通过UBE2T介导的反馈机制驱动了以磷酸戊糖途径(PPP)为主的中心碳代谢重编程。同时研究者开发出一种结合F-127、UBE2T抑制剂PGG 和KRASG12D抑制剂MRTX1133的纳米共递送系统,在KRASG12突变型胰腺导管腺癌(PDAC)中诱导了显著的肿瘤消退和持久的治疗反应。
胰腺导管腺癌(PDAC)是一种高度致死性的恶性肿瘤,其发病率不断上升,5年总体生存率仅为12%。尽管近年来新兴的免疫疗法和靶向治疗(如帕博利珠单抗和奥拉帕利)已获批用于PDAC治疗,但其仅适用于少数罕见的分子亚型。KRASᴳ¹²ᴰ是PDAC中最常见的致癌突变,约45%的患者携带该突变。长期以来,KRASᴳ¹²ᴰ被认为是“不可成药”的靶点。然而近期开发的一种新的非共价、高选择性的KRASᴳ¹²ᴰ抑制剂MRTX1133,它可以有效抑制KRASᴳ¹²ᴰ介导的PDAC恶性进展。但KRAS抑制剂耐药仍不可避免。KRAS上下游信号通路的再激活及反馈补偿是导致MRTX1133耐药并严重影响疗效的重要机制。因此,深入探究KRASᴳ¹²ᴰ介导MRTX1133耐药的分子机制至关重要。
焦作义教授团队发现KRASG12D突变型PDAC可通过PPP代谢重编程导致恶性进展及MRTX1133治疗耐药,并提出创新性联合治疗策略。他们发现KRASG12D通过激活Rb/E2F1/UBE2T信号轴形成级联调控网络,促进p53降解以解除其对G6PD酶活性的抑制,同时反馈上调UBE2T表达水平,最终导致PPP代谢异常活化。通过基因敲除或小分子抑制剂靶向UBE2T可有效抑制PDAC进展并显著增强KRASG12D抑制剂MRTX1133的治疗敏感性。基于此,他们创新性地构建了以Pluronic F-127为载体、共载UBE2T抑制剂PGG与MRTX1133的自组装纳米药物递送系统。该体系在PDAC患者来源异种移植模型和自发成瘤模型中展现
 |
出优异的协同治疗效果,实现85%的总缓解率和100%的无进展生存率。
文章图形摘要
在这项研究中,该研究团队发现胰腺癌中KRASᴳ¹²ᴰ驱动的中心碳代谢模式更加偏好于PPP。相较于糖酵解及三羧酸循环代谢抑制剂,PPP代谢抑制剂与MRTX1133的协同效应最强。动物实验亦证实PPP的阻断可有效抑制KRASG12D突变PDAC恶性进展、增效MRTX1133。
该团队进一步研究发现KRASᴳ¹²ᴰ介导的PPP代谢重塑依赖于泛素结合酶UBE2T调控的p53泛素化降解。为明确KRASG12D对UBE2T的调控模式,团队发现KRASᴳ¹²ᴰ可促进UBE2T转录上调,经过转录因子预测、双荧光素酶报告基因实验及DNA Pull-Down实验证实KRASG12D对UBE2T的调控依赖于转录因子E2F1且UBE2T介导的p53泛素化降解可通过两个正反馈环路促进UBE2T自身的转录:(1)p53降解解除p21对Rb的去磷酸化作用以促进E2F1转录活性,导致UBE2T转录上调;(2)p53降解其对E2F1转录活性的抑制从而上调UBE2T转录。由此可见,UBE2T是该环路的关键分子,UBE2T基因敲除及抑制剂PGG干预均可有效抑制KRASᴳ¹²ᴰ突变PDAC的恶性进展及增效MRTX1133。
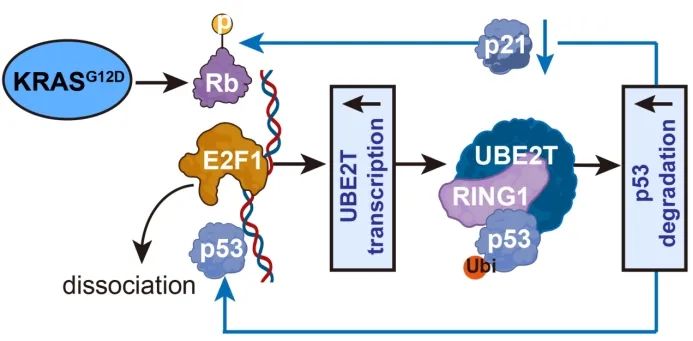
KRASG12D/E2F1/UBE2T/p53双反馈环促进胰腺癌能量代谢重编程机制图
鉴于天然化合物PGG对UBE2T的高亲和力靶向性,该研究团队提出PGG联合MRXT1133治疗KRASG12D突变PDAC的治疗策略。药物协同分析表明PGG与MRTX1133具有良好的协同效应。动物实验亦证实PGG可有效治疗KRASG12D突变PDAC,同时增效MRTX1133。该团队基于PGG独特的结构优势开发了以Pluronic F-127为载体、共载UBE2T抑制剂PGG与MRTX1133的自组装纳米药物MFP,PGG酚羟基(-OH)与F127中PEO链的-O基可通过氢键相互作用形成纳米外壳,将MRTX1133包载在核内。纳米药物MFP可有效治疗KRASG12D突变PDAC,在人源及鼠源胰腺癌动物模型中实现了持久缓解(85%总缓解率)和长期生存(100%无进展生存率)。
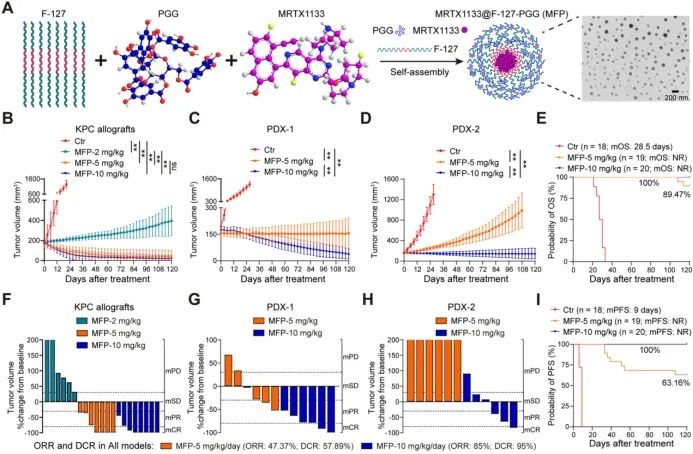
MFP结构示意图及在动物模型中的治疗结果
本研究首次揭示了KRASG12D/E2F1/UBE2T/p53双反馈环促进PPP代谢重塑导致PDAC恶性进展及MRTX1133耐药的具体分子机制,并提出了UBE2T抑制剂PGG联合MRTX1133的胰腺癌治疗新策略。针对KRASG12D靶向治疗耐药这一国际难题,创新性提出"靶向突变蛋白+抑制代偿通路"的协同治疗策略。通过构建靶向UBE2T的纳米共递送药物系统,在动物模型中实现100%无进展生存,为胰腺癌这一"癌王"的精准治疗提供了具有临床转化潜力的解决方案。该研究从分子机制到临床前验证形成完整证据链,不仅为胰腺癌治疗提供了创新性联合治疗方案,更为靶向治疗时代如何破解耐药困境提供了方法论参考,体现了基础研究向临床转化的重要桥梁作用。
来源:iNature
- 随机文章
- 热门文章
- 热评文章
- 《2024成都咖啡行业调查报告》发布:90后是咖啡消费主力军今
- 知名男团登机插队引众怒明星无特权公众人物更应遵守公共秩序
- 绵阳市盐亭华宸英才学校开展学雷锋主题教育活动
- 东山这一码头建成,5月投入使用!
- 国家能源集团官网删除拟录用公示名单引关注,官方通报:3名本科
- 能不能买到要看运气?老铺黄金最高涨价12%
- 5个整版!5个为什么!关于哪吒,《成都日报》今日推出深度剖析
- 校长曾良凌晨逝世,年仅54岁,年初还在上思政课
转载请注明来自知行看点,本文标题:《Cell子刊丨兰州大学第二医院焦作义教授团队提出胰腺癌治疗新策》














 京公网安备11000000000001号
京公网安备11000000000001号 京ICP备11000001号
京ICP备11000001号